Practische opdracht
Scheikunde 2007/2008 4-vwo t/m practicum 5 van module 4
Naam: Klas: Docent:
Deel A (samen) 50
minuten
Opdracht 1 Litermassa’s
bepalen
In
practicum 3 van module 4 heb je gezien hoe je m.b.v. volumeverhoudingen van
gasvormige stoffen bij reacties verschillende formules kunt toekennen aan
stoffen, ook als ze dezelfde kommaformule hebben. Zulke formules noemen we
chemische formules.
5p a. Geef de chemische formule die we hebben toegekend aan: koolstofdioxide, koolstofmonoxide, waterstofchloride, waterstof en ammoniak.
Als je in het toestel van Hofmann 0,029 mL water laat verdwijnen ontstaat 40 mL waterstof en 20 mL zuurstof.
2p b. Legt uit dat je op basis van deze gegevens toch niet een chemische formule aan water kunt toekennen.
4p c. Laat aan de hand van een berekening zien dat in dit geval
sprake is van massabehoud (zoals bij alle chemische reacties).
Gebruik bij deze berekening gegevens uit het TUE-tabellenboekje.
In plaats van de volumeverhouding van gasvormige stoffen bij een reactie rechtsreeks te méten kun je soms makkelijker de massaverhouding bepalen en dan m.b.v. de litermassa’s de volumeverhouding berékenen.
Je moet dan wel litermassa’s van gassen en dampen kennen.
Zelf heb je de litermassa van aardgas bepaald door een portie aardgas in een plastic zakje te wegen. Daarbij deed zich de complicatie voor dat het zakje met aardgas mínder woog dan het leeggeperste zakje.
2p d. Hoe komt het dat een zakje met aardgas minder weegt dan datzelfde leeggeperste zakje?
In dit onderdeel van deze praktische opdracht ga je de litermassa van alcoholdamp bepalen.
Alcohol is gasvormig bij temperaturen boven 78 °C, dat is het
kookpunt van alcohol.
De litermassabepaling van alcoholdamp komt op het volgende neer: het volume van
een portie alcohol bepalen boven 78 °C, de massa van die portie bepalen onder
“normale” omstandigheden.
Hieronder staat de werkwijze voor de litermassabepaling van gasvormig alcohol kort samengevat. Daarna volgt een gedetailleerde instructie.
- Een erlenmeyer, voorzien van een stop met capillair, wordt
gewogen.
- In de erlenmeyer wordt zolang een portie vloeibare alcohol
verwarmd totdat de vloeistof helemaal
verdampt is en de
erlenmeyer dus vol zit met alcoholdamp.
- De erlenmeyer met alcoholdamp wordt snel afgekoeld zodat de
damp condenseert.
- De erlenmeyer met gecondenseerde alcohol wordt gewogen, je
kent dan de massa van de alcoholdamp.
- Het volume van de erlenmeyer wordt bepaald, je kent dan het
volume van de alcoholdamp.
1. Weeg een droge erlenmeyer met stop waardoor een capillair (bijvoorbeeld een injectienaald) is gestoken, tot op 0,01 gram nauwkeurig.
1p e. Wat is de massa van de droge erlenmeyer met stop en capillair?

2. Vraag aan je begeleider om wat alcohol in
de erlenmeyer te doen. (Het kan zijn dat dat
er wat kleurstof is toegevoegd zodat je de
vloeistof beter kunt zien.)
3. Doe de erlenmeyer zo hoog mogelijk
bij hals of de stop in een klem.
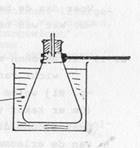 4.
Zet alvast een bekerglas met koud water
4.
Zet alvast een bekerglas met koud water
klaar waarin de erlenmeyer straks onder-
gedompeld kan worden.
koud
water
 5.
Maak een waterbad klaar waarin de
5.
Maak een waterbad klaar waarin de
erlenmeyer met inhoud verwarmd kan
worden.
6. Zorg ervoor dat je de temperatuur van het waterbad kunt meten.
Regel het zo dat de temperatuur van het water hoger is dan 78°C (zodat de
alcohol snel verdampt) maar lager is dan 100 °C (zodat het zicht op de alcohol
niet verhinderd wordt door kokend water).
We nemen aan dat de temperatuur van de damp ín de erlenmeyer gelijk is aan de
temperatuur van het water eromheen.

7. Houd erlenmeyer met alcohol
zolang in het het waterbad totdat
je geen vloeistof meer ziet, meet
dán de temperatuur van het water
en dompel de erlenmeyer dan
metéén in het koude water.
1p f. Wat is de temperatuur van de alcoholdamp?
8. Droog de erlenmeyer goed af, zonodig ook stop en capillair.
Weeg de erlenmeyer met stof, capaillair en alcohol op 0,01 gram nauwkeurig.
1p g. Wat is de massa van de erlenmeyer, stop, capillair en alcohol?
9. Bedenk zelf hoe je het volume van de (damp in de) erlenmeyer zou kunnen bepalen.
2p g. Schrijf de door jullie bedachte methode hieronder op.
Overleg met je begeleider over jullie antwoord op g en voer de bepaling na goedkeuring uit.
1p h. Wat was het volume van de alcoholdamp in de erlenmeyer?
4p i. Bereken m.b.v. de antwoorden op e, g en h de litermassa van gasvormig alcohol bij de temperatuur van f.
|
massa alcohol |
0,17 gram |
|
volume alcoholdamp |
107 mL |
Hiernaast staan gegevens van
een andere bepaling bij 80 °C:
2p j. Bereken de litermassa
van alcoholdamp bij een temperatuur van
80 °C op basis van deze gegevens.
2p k. Stemt de litermassa die berekend is op basis van de door jullie zelf gemeten gegevens ongeveer overeen met de waarde die je kunt berekenen uit de boven j aangereikte gegevens? Noem mogelijke oorzaken voor eventuele verschillen.
Bij vraag d heb je aangegeven hoe het komt dat een leeggeperst plastic zakje meer weegt dan datzelfde zakje met aardgas erin.
Bij de bepaling van de litermassa van aardgas moest je dan ook corrigeren voor deze “storende” factor.
2p l. Leg uit of je bij de bepaling van de litermassa van alcohol op de manier zoals je die in deze opdracht hebt uitgevoerd, wel of niet moet corrigeren voor deze “storende” factor.
Met behulp van de algemene gaswet (waarover je bij het vak
natuurkunde meer leert) kun je de litermassa van alcohol omrekenen naar een
temperatuur van 25 °C zodat je kunt vergelijken met de litermassa’s uit
TUE-tabel 8.
Op basis van de aangereikte gegevens vind je dan voor alcohol een “liter”massa
van 1,88 g/L. (We schrijven “liter”massa en niet litermassa omdat alcohol bij
25 °C en een druk van 1,0 bar niet in gasvorm voorkomt, het betreft dus een
berekende waarde.)
Opdracht 2 Een chemische formule voor alcohol
In de voorgaande opdracht staat beschreven hoe je voor gasvormig alcohol een “liter”massa bij 25 °C kunt berekenen hoewel pure alcohol onder die omstandigheden niet gasvormig is. Ook voor andere stoffen met een kookpunt hoger dan bij 25 °C kan op soortgelijke manier een “liter”massa gevonden worden.
1p a. Zoek in TUE-tabel 10 de “liter”massa van water op.
Met behulp van liter- en “liter”massa’s kan uit de massaverhouding bij een reactie de volumeverhouding berekend worden als ware alle betrokken stoffen in gasvorm.
Zo ontstaat er bij de volledige verbranding van 2,00 gram alcohol 3,83 gram water en 2,35 gram koolzuurgas.
2p b. Bereken hoeveel gram zuurstof er bij de volledige verbranding van 2,00 gram alcohol verdwijnt.
4p c. Laat met berekeningen zien dat uit de massaverhouding, waarin alcohol, zuurstof, water en koolzuurgas bij de verbranding betrokken zijn, een volumeverhouding volgt van 1,0 : 3,0 : 3,0 : 2,0 .
Uit de volumeverhouding kun je aflezen dat uit 1,0 “liter” alcohol 3,0 “liter” water ontstaat.
4p d. Leg uit welke index er (dus) moet staan bij H in de chemische formule van alcohol.
Op een analoge manier kunnen ook de indices 2 en 1 gevonden worden bij de andere twee elementen C respectievelijk O van alcohol.
Lever deel A in.
Ruim alle spullen op.
Ga dan individueel verder met deel B.
Practische opdracht
Scheikunde 2007/2008 4-vwo t/m practicum 5 van module 4
Naam: Klas: Docent:
Deel B (indivudueel) 50
minuten
Opgave 1 Alcohol
Als je stearine(kaarsvet) onvolledig verbrandt ontstaan o.a. water, koolstofmonooxide, koolstofdioxide en roet. Dit roet bestaat voor het grootste deel uit koolstof. Voor koolstof gebruiken chemici de chemische formule C1.
4p a. Beschrijf deze reactie met een reactieschema waarin je behalve voor stearine chemische formules gebruikt.
2p b. Geef twee mogelijke kommaformules die je op basis van bovenstaande gegevens aan stearine kunt toekennen.
2p c. Beschrijf puntsgewijs de in practicum 8 van module 2 aangereikte methode om te laten zien dat stearine een stof is zonder element zwavel. (Als je dat niet van buiten weet kan je samenvatting misschien helpen?)
Door experimenten zoals hierboven beschreven kun je erachter komen dat aan de stoffen suiker, alcohol, fructose en glucose dezelfde kommaformule C,H,O moet worden toegekend.
Om toch ook aan deze stoffen verschíllende formules te kunnen toekennen verwerken chemici niet alleen kwalitatieve maar ook kwantitatieve gegevens in de formules. Deze kwantitatieve gegevens zijn ontleend aan de volumeverhoudingen bij reacties van stoffen in gasvorm. Zo is in deel A van deze praktische opdracht aan alcohol de chemische formule C2H6O1 toegekend.
Omdat chemische formules gebaseerd zijn op volumeverhoudingen van gasvormige stoffen bij reacties kun je er ook voorspellingen mee doen.
2p d. Voorspel aan de hand van de chemische formules van alcohol en water hoeveel liter waterdamp er maximaal kan ontstaan als 5,7 liter alcoholdamp ontleed wordt.
Jan en Sofie willen de voorspelling van d verifiëren. Ze berekenen m.b.v. de “liter”massa uit TUE-tabel 10 de massa van 5,7 liter alcoholdamp en daarna m.b.v. de dichtheid van alcohol uit BINAS-tabel 11 met hoeveel mL vloeibare alcohol dat overeenkomt.
4p e. Laat zien op hoeveel mL (vloeibare alcohol) ze dan uitkomen.
Jan en Sofie passen de berekende hoeveelheid alcohol af en proberen die te ontleden door te verhitten. Maar de alcohol vliegt in brand.
2p f. Hoe hadden ze kunnen voorkomen dat de alcohol in brand vloog?
Omdat er niet alleen ontleding maar ook verbranding plaatsvindt zal de hoeveelheid waterdamp die ontstaat anders zijn dan je bij d voorspeld hebt.
4p g. Voorspel aan de hand van de chemische formules van alcohol en water hoeveel liter waterdamp er maximaal kan ontstaan als 5,7 liter alcoholdamp verbrand wordt.
Opgave 2 Koolhydraten
Aan alcohol kun je een chemische formule toekennen doordat je van een portie alcohol de “liter”massa kunt bepalen. Je hebt dat zelf gedaan in deel A van deze praktische opdracht.
Voor koolhydraten als fructose, glucose, galactose en suiker is dat lastiger want als je die aan de kook probeert te brengen, ontleden ze.
2p a. Hoe ziet glucose eruit bij kamertemperatuur?
Noem kleur en fase (= vorm).
In practicum 5 van module 4 heb je gezien hoe je m.b.v. regelmaat bij vriespuntverlaging (vpv) toch een “liter”massa aan dit soort stoffen kunt toekennen.
De (geëxtrapoleerde) regelmaat bestaat hierin dat 1,0 liter van een gasvormige stof, opgelost in 100 gram water, altijd voor een vpv van 0,75 °C zorgt.
4p b. Laat met een berekening zien dat je op basis van deze regelmaat als vriespunt van een oplossing van 10,7 gram alcohol in 100 gram water – 4,3 °C moet verwachten.
Een oplossing van 3,67 gram galactose in 100 gram water heeft een vriespunt van – 0,37 °C.
4p c. Bereken eerst hoeveel “liter” galactose er is opgelost en daarna de “liter”massa voor galactose.
Op dezelfde manier kan voor glucose, fructose en suiker de “liter”massa bepaald worden die in TUE-tabel 10 vermeld staat.
Met behulp van liter- en “liter”massa’s kan uit de massaverhouding bij een reactie de volumeverhouding berekend worden als ware alle betrokken stoffen in gasvorm.
Zo ontstaat er bij de volledige verbranding van 7,4 gram galactose
4,38 gram water en 10,8 gram koolzuurgas.
2p d. Bereken hoeveel gram zuurstof er bij de volledige verbranding van 7,4 gram galactose verdwijnt.
4p e. Leid uit de mássaverhouding, waarin galactose, zuurstof,
water en koolzuurgas bij de verbranding betrokken zijn, een volumeverhouding
af.
(Als je bij c geen “liter”massa voor galactose gevonden hebt mag je in plaats
daarvan de “liter”massa van glucose gebruiken.)
Op basis van de volumeverhoudingen bij reacties kunnen chemische formules worden toegekend.
1p f. Welke chemische formule staat in BINAS-tabel 66B voor (biet)suiker vermeld?
Voor fructose én voor glucose vind je dezélfde chemische formule C6H12O6.
2p g. Bedenk een manier om de formule C6H12O6 zo aan te passen dat duidelijk is dat er glucose of fructose mee bedoeld wordt.